[togglegroup]
[toggle title=»DUDAS EN OSTEOPOROSIS»]
[expand title=»1. ¿Qué es la osteoporosis?«]
[row]
[two_third]
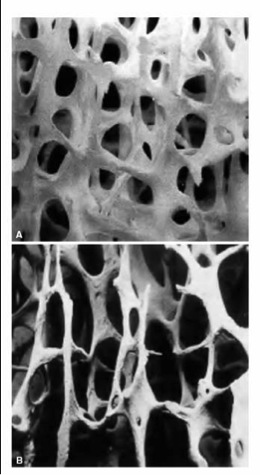
La osteoporosis es aquella enfermedad que afecta a los huesos y que se caracteriza por una baja masa ósea y por el deterioro microestructural del tejido óseo, con el consiguiente aumento de la fragilidad del hueso y por lo tanto, el aumento en la producción de fracturas. Es aquel hueso que presenta una mineralización normal pero en menor cantidad (hueso poroso). Es la enfermedad ósea más prevalente y el segundo problema en importancia en el campo de la salud tras las enfermedades cardiovasculares.
Se estima que 1 de 3 mujeres y 1 de 12 hombres de más de 50 años tienen osteoporosis. En España se fracturan la cadera cada año 80.000 personas. Pero eso no es todo, 720000 se rompen alguna vértebra y 200000 se rompen la muñeca anualmente. En nuestro país, la prevalencia de la osteoporosis llega al 6.5% de la población, o lo que es lo mismo, 2.5 millones de personas. Con estas cifras, en Europa, cada 30 segundos se produce una fractura por osteoporosis. El número de éstas ha aumentado de forma exponencial en los últimos años.
En España, el tratamiento de un paciente con fractura de cadera puede llegar a los 100.000 euros.
Pero, lo más descorazonador de todo es que sólo el 10% de los pacientes con la enfermedad reciben tratamiento. En muchos casos, el paciente es diagnosticado cuando se le ha producido alguna fractura.
Se estima que 1 de 3 mujeres y 1 de 12 hombres de más de 50 años tienen osteoporosis. En España se fracturan la cadera cada año 80.000 personas. Pero eso no es todo, 720000 se rompen alguna vértebra y 200000 se rompen la muñeca anualmente. En nuestro país, la prevalencia de la osteoporosis llega al 6.5% de la población, o lo que es lo mismo, 2.5 millones de personas. Con estas cifras, en Europa, cada 30 segundos se produce una fractura por osteoporosis. El número de éstas ha aumentado de forma exponencial en los últimos años.
En España, el tratamiento de un paciente con fractura de cadera puede llegar a los 100.000 euros.
Pero, lo más descorazonador de todo es que sólo el 10% de los pacientes con la enfermedad reciben tratamiento. En muchos casos, el paciente es diagnosticado cuando se le ha producido alguna fractura.
[/two_third]
[one_third]
[/one_third]
[/row]
[/expand]
[expand title=»2. ¿Podemos detectar si un paciente sufre osteoporosis?«]
Cuando un paciente nos es derivado por otro especialista o por su médico de cabecera, debemos protocolizar una sistemática que nos ayude a detectar mejor la posible presencia de osteoporosis.
[row]
[two_third]
- Reconocer los factores de riesgo de padecer osteoporosis.
o Edad: último tercio de la vida.
o Mujer
o Antecedentes familiares de osteoporosis
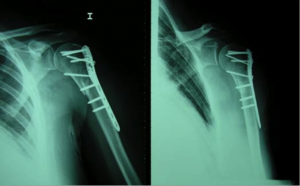
o Haber sufrido una fractura por fragilidad >45 años. La presencia de una fractura por fragilidad como las de húmero, muñeca o vértebra aumentan el riesgo de sufrir una nueva fractura entre un 1.5 y 9.5 veces.
o Fractura de cadera.
o Fumadores > 1 paquete/día.
o Sedentarismo
o Delgadez (IMC < 19).
o Menopausia antes de los 45 años.
o Tratamiento prolongado con corticoides, quimioterapia, litio, anticonvulsivantes.
[/two_third]
[/row]
- Reconocer los factores de riesgo de sufrir una fractura osteoporótica.
o Edad avanzada.
o Antecedentes personales o familiares de haber sufrido una fractura por fragilidad.
o Tabaquismo > 1 paquete/día y/o importante ingesta de alcohol.
o Delgadez importante.
o Pobre agudeza visual
o Demencia
o Baja ingesta de calcio y vitamina D
o Sedentarismo y escaso ejercicio físico.
o Padecer enfermedades como Parkinson, artritis reumatoide, DMID, o hipertiroidismo.
o Empleo de sedantes, tranquilizantes o antidepresivos.
[/expand]
[expand title=»3. ¿La osteoporosis duele?«]
En las fases iniciales de la enfermedad, ésta muestra un curso silente y progresivo (de ahí el término acuñado como la epidemia silenciosa). La exploración física puede ser normal, de ahí que estemos muy pendientes de los 2 apartados anteriores para poder realizar exploraciones complementarias que nos confirmen la sospecha, iniciar un tratamiento y advertir a la paciente sobre las consecuencias de no cumplirlo y programar una revisión en un período de tiempo no prolongado y comprobar la variación del estado físico.
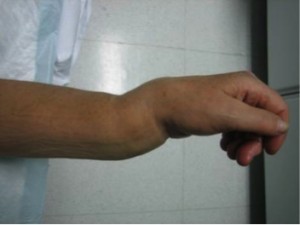
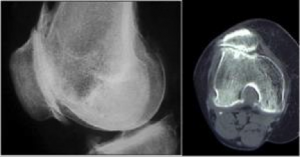
Fractura de muñeca
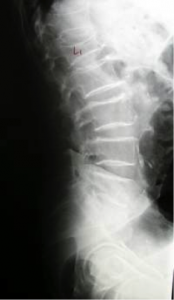
El principal motivo de consulta de estos pacientes suele ser el DOLOR. La localización de éste puede ser variable, pero la gran mayoría se concentran en la espalda y sobre todo en la zona dorsal interescapular con una mayor prevalencia; también puede darse en las ingles, muñecas u hombros. La osteoporosis vertebral provoca dolor de características mecánicas, insidioso, irradiado a la región anterior del tórax en ocasiones y muy incapacitante que puede precisar de reposo en cama. Puede iniciarse tras la realización de un esfuerzo brusco, levantar un peso o simplemente estornudar. La causa suele ser la aparición de microfracturas que pasan desapercibidas en los estudios radiológicos, la contractura de la musculatura paravertebral y la artrosis asociada.
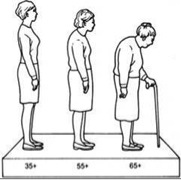
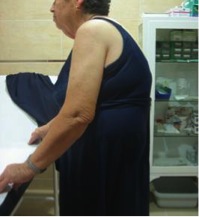
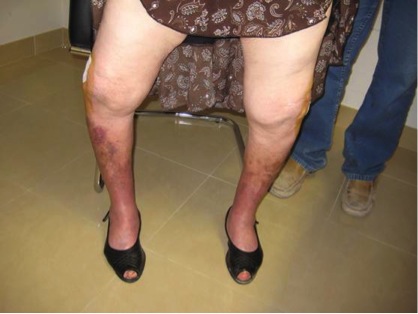
Es frecuente que el paciente asocie una deformidad característica a nivel dorsal como es la aparición de la cifosis dorsal y la correspondiente compensación cervical y lumbar mediante una hiperlordosis y un abombamiento a nivel abdominal.
En este punto es importante preguntar al paciente o a sus acompañantes si ha notado que ha perdido estatura; la respuesta suele ser SÍ. Es frecuente que se acorte la distancia que hay entre los últimos arcos costales y las crestas ilíacas, por lo que la deformidad sin tratamiento suele progresar y empeorar, pudiendo superar los 5 cm.
Es importante fijarse cómo caminan, si se aprecia falta de coordinación e inseguridad al andar, si hay debilidad muscular (puede indicar que hay una falta de vitamina D), si precisa ayuda para su aseo personal y sus actividades cotidianas, si sale a la calle, usa bastón o andador, si hay miedo a tener una caída.
No debemos olvidar que en estos pacientes puede asociarse otra enfermedad inherente a la edad como es la artrosis que puede justificar parte de la clínica antes referida. Es importante diferenciar estos aspectos para poder llegar con éxito al diagnóstico.
[/expand]
[expand title=»4. ¿Qué pruebas son necesarias para el diagnóstico de osteoporosis?«]
- Analítica de rutina
o Las pruebas analíticas convencionales no son especialmente sensibles a la hora de confirmar el diagnóstico de osteoporosis. No hay una relación directa entre los hallazgos de ésta y el riesgo de sufrir una fractura. Sin embargo, sí es importante para descartar la presencia de enfermedades del metabolismo mineral. Los parámetros a solicitar son:
o Calcio, fósforo y magnesio plasmáticos.
o PTH: su ascenso puede hacernos pensar en un hiperparatiroidismo primarios; en algunos casos de osteoporosis con niveles plasmáticos de calcio bajos, la PTH puede encontrarse elevada como un hiperparatiroidismo secundario.
o 25 hidroxivitamina D y 1,25 dihidroxivitamina D: se pueden encontrar disminuidas en pacientes fumadoras, en las que tengan una baja ingesta de vitamina D o en las que la producción renal se encuentre reducida.
o Hormonas tirodeas.
o Testosterona en varones: podemos descartar la presencia de un hipogonadismo.
o Betaestradiol en mujeres.
- Marcadores de remodelado.
o Son útiles para identificar a la población con osteoporosis que presente un mayor riesgo de fractura y sobre todo para la valorar la respuesta del paciente al tratamiento antirresortivo y poder así monitorizar el grado de eficacia y cumplimiento del fármaco. Están indicados sobre todo para mujeres postmenopáusicas.
o Desde el punto de vista clínico, los más recomendables para valorar la formación ósea son:
o Fosfatasa alcalina ósea: es una determinación de las más sensibles y específicas de la formación ósea.
o Propéptido carboxiterminal del colágeno tipo 1 (PICP).
o En cuanto a la resorción, Telopéptido carboxiterminal del colágeno tipo 1 (CTX): se ha mostrado muy sensible en el estudio de la resorción de la osteoporosis postmenopáusica.
o Péptido aminoterminal del colágeno tio 1 (NTX) en orina.
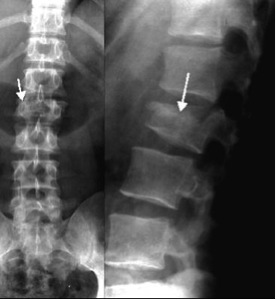
- Estudio con Rx simple.
o La radiografía simple es la técnica más sencilla y coste-efectiva de realizar sobre todo para el diagnóstico inicial de la fractura vertebral. Para un diagnóstico acertado se deben conjugar los hallazgos radiológicos con la exploración clínica; de esta manera, algunos hallazgos o deformidades debidas a enfermedades degenerativas evitamos confundirlos con fracturas recientes.
o En un paciente con sospecha de osteoporosis, es la primera prueba que hay que realizar. La osteopenia puede ser visible en la Rx cuando la pérdida de masa ósea oscila entre el 30-50%, lo que hace que veamos el hueso más radiotransparente de lo habitual.
o ¿De qué localización se realiza? La radiografía de columna, sobre todo dorsal y lumbar es la obligada a realizar en primer lugar. En numerosas ocasiones es difícil determinar si hay aplastamiento vertebral; éste debe suponer un colapso de al menos el 20% de la vértebra, ya sea de la zona anterior, de la zona media o de la totalidad de la vértebra.
o La radiolucencia se puede detectar en otras localizaciones como la cadera, la muñeca o el húmero proximal.
o Si hay dudas con el diagnóstico mediante la Rx simple, debemos recurrir al TAC.
- Densitometría ósea.
o La más usada es la DEXA. Es el mejor predictor de sufrir una fractura por fragilidad. Debemos realizarla a todos los pacientes que sospechemos de estar en riesgo de sufrir una fractura por fragilidad y en aquellos que están siendo tratados farmacológicamente contra la osteoporosis, como medida de eficacia del tratamiento.
o En nuestro medio es una exploración no disponible en todos los centros, o bien, la presión asistencial demora en exceso su realización. Por ello, esta prueba no es imprescindible para la confirmación del diagnóstico. La presencia de factores de riesgo, manifestaciones clínicas y hallazgos radiológicos son suficientes evidencias para comenzar el tratamiento.
[/expand]
[expand title=»5. ¿Cuáles son las bases del tratamiento de la osteoporosis?«]
Los objetivos del tratamiento para la osteoporosis son:
- Controlar el dolor.
- Retardar o detener el proceso de pérdida ósea y prevenir fracturas
o Nunca se es demasiado mayor ni demasiado joven como para mejorar la calidad de nuestros huesos. En el mercado hay numerosos productos excelentes para dotar de calidad a nuestros maltrechos huesos.
o Los podemos clasificar en 3 tipos:
o Fármacos antirresortivos: de ellos los más potentes son los bifosfonatos. Estos actúan inhibiendo la resorción ósea normal y patológica la inhibir a los osteoclastos. Los más usados son alendronato (FOSAVANCE, ALENDROCARE, FOSAMAX), risedronato (ACREL, ACTONEL), ibandronato (BONVIVA) y zoledronato (ACLASTA) en pautas semanal, mensual o anual. Son eficaces en la reducción de fracturas de cadera y vertebrales.
o Fármacos osteoformadores: teriparatida (FORSTEO) y la 1-84 PTH (PREOTACT). Reducen de forma significativa la incidencia de fracturas vertebrales y no vertebrales entre un 50 y 65%. La duración del tratamiento es de 18 meses y 24 meses, respectivamente. Una vez acabado este período, deberemos realizar una terapia secuencial con un bifosfonato.
o Acción dual: Ranelato de estroncio (PROTELOS). Disminuye por un lado la reabsorción ósea y por otro estimula la formación. Presenta una reducción del riesgo de fractura en vertebral y no vertebral; reducción del riesgo en todos los grupos de edad; reducción del riesgo de forma duradera.
o Propiedades: -Mejora la microarquitectura trabecular
o Mejora la geometría cortical aumentando el grosor endosteal y periosteal.
o Aumenta la DMO en cadera y columna lumbar.
o No produce anormalidades en la mineralización ósea.
[/expand]
[expand title=»6. ¿Se debe asociar calcio o vitamina D al tratamiento?«]
Es muy importante asociar a estos tratamientos calcio y vitamina D. Con dosis de 400 U al día de vitamina D se ha demostrado un aumento de la densidad mineral ósea en la cadera. También se ha demostrado que con la vitamina D disminuye la frecuencia de caídas, hecho que se derivaría también de su acción muscular, lo que puede relacionarse con la discrepancia de resultados respecto a su papel preventivo sobre las fracturas. Sabemos que hay una elevada prevalencia de insuficiencia e incluso de deficiencia de vitamina D. Por ello, debemos insistir en la necesidad de no olvidar valorar la administración de suplementos de vitamina D en las poblaciones con riesgo de presentar osteoporosis.
El caballo de batalla en el tratamiento contra la osteoporosis estriba en el cumplimiento por parte del paciente. En algunos estudios éste es inferior al 50%.
[/expand]
[expand title=»7. ¿Qué puede hacer el paciente para prevenir la osteoporosis?«]
Hábitos de vida saludable. Minimizar el riesgo de caídas que podrían causar fracturas
Hay 5 recomendaciones básicas que tenemos que hacer a nuestros pacientes osteoporóticos:
- Abandonar el tabaco.
- Dieta adecuada sobre todo de calcio y vitamina D.
- Exposición solar moderada.
- Ejercicio físico diario: caminar entre 30 y 60 minutos. Debe ser progresivo en la intensidad y duración, no se trata de competir con otras personas. El objetivo es mejorar el equilibrio, la coordinación y la capacidad de caminar, aumentar la independencia, mejorar la flexibilidad y disminuir las probabilidades de sufrir caídas; cuidar el bienestar psicológico y la autoestima. Debemos personalizar el ejercicio en función de las limitaciones de cada paciente.
- Ojo con las superficies húmedas: usar bastón.
- Dejar las manos libres al salir de casa.
- Cuidado con cosas en el suelo: alfombras, cables del teléfono
- NO caminar en calcetines o medias en casa
- Ojo con los escalones
- Interruptores cerca de las puertas.
- Ojo en el baño. Colocar barras y soportes en la ducha y cerca del inodoro
- uso de fajas con protectores en la zona de los trocánteres; ayuda a absorber impactos y pueden reducir la incidencia de fracturas hasta en un 50%.
[/expand]
CONCLUSIONES
Los cirujanos ortopédicos tenemos responsabilidades…
- La fractura osteoporótica es muchas veces el primer signo de la osteoporosis y siempre una llamada de atención
- La presencia de una fractura osteoporótica es un factor de riesgo para otras fracturas
- El cirujano ortopédico es el profesional que mejor puede valorar la necesidad de instaurar profilaxis
- El cirujano ortopédico ocupa un excelente lugar de observación
- En la literatura reciente se aprecia un creciente interés en el papel del traumatólogo en el tratamiento y prevención de la osteoporosis.
EJERCICIOS PARA LOS PACIENTES CON OSTEOPOROSIS
[/toggle]
[toggle title=»DUDAS EN ARTROSIS»]
[expand title=»1. ¿Qué es la artrosis?«]
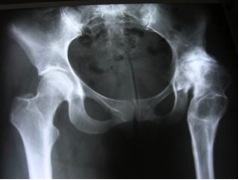
La artrosis es la forma de discapacidad musculoesquelética crónica más frecuente sobre todo cuando afecta a cadera y rodilla. Puede afectar a 1 de cada 5 personas que se encuentren en estas edades, llegando a invalidar al 10% de la población que la padece.
Definimos artrosis como el resultado de eventos mecánicos y biológicos que desestabilizan el proceso de creación y destrucción de los condrocitos, de la matriz extracelular y del hueso subcondral, pudiendo llegar a provocar en sus estadíos más avanzados, dolor, inflamación, crepitación, pérdida del rango de movilidad y de función articular.
Dependiendo de que se conozca la causa o no que inicia la enfermedad, hablaríamos de artrosis primarias o idiopáticas y de artrosis secundarias a alguna causa, como por ejemplo una fractura intraticular.
Por orden de frecuencia, las articulaciones de las manos, las de la columna vertebral, la rodilla, la cadera y la metatarsofalángica del primer dedo del pie, son las más frecuentes
La progresión de esta enfermedad es exponencial dado el aumento en la prevalencia de la población anciana en nuestro días. Se estima que el número de artroplastias totales de rodilla se incrementará en un 10% en los próximos años y las de cadera en un 2.5%.
En cuanto a las causas implicadas en el inicio y desarrollo de la enfermedad, varios factores se han postulado como los posibles causantes:: el peso corporal, la edad, el sexo, la actividad laboral, la práctica deportiva, la densidad mineral ósea, la terapia hormonal sustitutiva, las lesiones previas, factores genéticos etc…
[/expand]
[expand title=»2. ¿Cómo y por qué duele la artrosis?«]
Aunque el cartílago es aneural y no posee terminaciones nervisioas, se sospecha que el dolor debido a la artrosis es secundario a las lesiones de las estructuras vecinas, como una elongación de la cápsula articular secundaria a la deformación progresiva del eje de la articulación, reacción perióstica, microfracturas del hueso subcondral, aumento de la presión venosa intraósea, y sinovitis.
Muchas veces las manifestaciones clínicas de la artrosis son inespecíficas y se podrían dar en cualquier enfermedad músculo-esquelética como pueden ser los chasquidos, la deformidad, la rigidez o la inestabilidad.
El dolor es el motivo de consulta más frecuente del paciente artrósico. Se exacerba con el uso (mecánico) y se alivia con el reposo. Puede empeorar con el cambio de tiempo, con el frío, y suele mejorar con el calor seco local, y un clima caluroso y seco. La rigidez es el segundo motivo de consulta al médico. Suele ser matutina o bien cuando el paciente ha estado en reposo unos minutos tras haber realizado una caminata o alguna actividad. El enfermo refiere que es una sensación como si la musculatura y todo el tejido periarticular los tuvieran pegados al hueso y eso le impide moverse con normalidad.
El paciente no puede realizar sus actividades de la vida cotidiana como puede ser su aseo personal, realizar ejercicio físico o simplemente ponerse unos calcetines. A veces la causa de esa discapacidad es el dolor, otras veces es debida al estrechamiento de las superficies articulares o al malalineamiento de una extremidad como ocurre en la gonartrosis severa; otras veces por la debilidad muscular asociada a la artrosis que puede provocar cierto grado de inestabilidad. Otro signo puede ser la inflamación de la articulación debida a la reagudización de la enfermedad y la coexistencia con una artritis, lo que provoca además del hidrartros, calor, enrojecimiento y dolor no sólo con el movimiento sino en reposo y sobre todo, por la noche, impidiendo el descanso nocturno.
“El dolor y la incapacidad funcional son los principales predictores de la evolución hacia una artroplastia; y ambos son los mayores determinantes de pérdida de calidad de vida de los pacientes”.
[/expand]
[expand title=»3.- ¿De qué arsenal diagnóstico disponemos?«]
La artrosis es una entidad clínica caracterizada no sólo por hallazgos clínicos, sino también radiológicos y en ocasiones, de laboratorio.
Los estudios complementarios con pruebas de imagen son los que nos dan el diagnóstico definitivo de la enfermedad. Un dato importante y a tener en cuenta, es que hay una disociación clínico-radiológica en la artrosis. Pacientes con unas manifestaciones clínicas importantes, inflamación y dolor, presentar un estudio radiográfico anodino o con poca severidad, y en cambio, patrones radiográficos extremos asociar poco dolor e incapacidad. La radiografía simple es la prueba de rutina inicial a realizar. Los exámenes de laboratorio habitualmente son normales tanto cuantitativa como cualitativamente en la mayoría de pacientes con artrosis. Los reactantes de fase aguda (VSG y PCR) son normales y únicamente se elevan durante las exacerbaciones inflamatorias o crisis que puede sufrir el paciente artrósico.
[/expand]
[expand title=»4.- ¿Cuál es la clave del tratamiento de la artrosis?«]
Los objetivos en el tratamiento de la artrosis son:
- Aliviar el dolor.
- Mejorar la capacidad funcional.
- Evitar la progresión de la enfermedad. Representa el fututo del tratamiento de la enfermedad.
Lo primero a la hora de prescribir un tratamiento es:
- ¿Cómo es el paciente?: la edad, comorbilidades y la medicación actual concomitante.
- ¿Cómo es la artrosis?: hay que valorar el grado de incapacidad, los tratamientos previos administrados, su eficacia y valorar el estadío radiológico de la enfermedad.
[/expand]
[expand title=»5.- Cambios en las manifestaciones clínicas de la enfermedad.«]
El dolor es el síntoma más frecuentemente asociado a la artrosis.
En cuanto a la función y el nivel de evidencia de cada tratamiento modificador de la sintomatología:
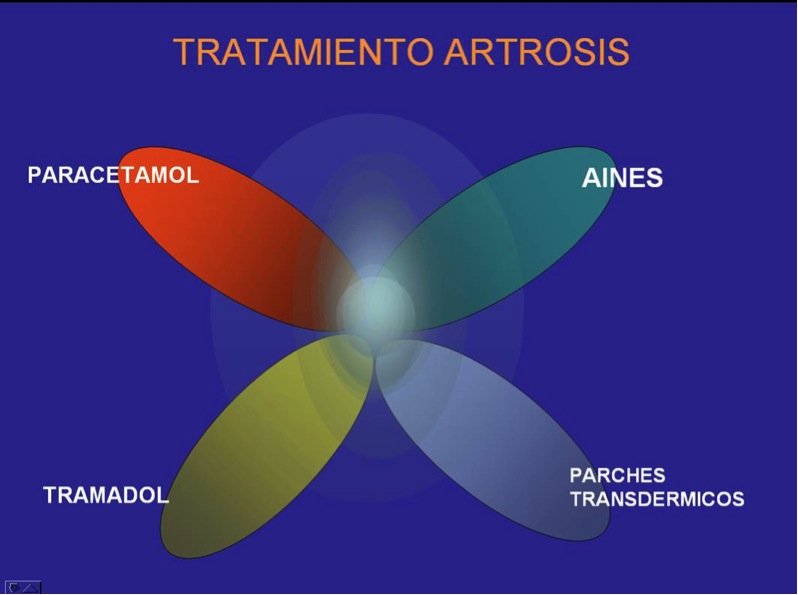
- Paracetamol: Es el fármaco inicial pata le tratamiento de la artrosis; es el primer peldaño terapéutico, debido a su eficacia, su escasa asociación con efectos secundarios graves y su escasa interacción con otros tratamientos. Su dosis es de 3-4 gr por día.
- Antiinflamatorios tradicionales (AINES): Poseen poder analgésico y antiinflamatorio. Se asocian al paracetamol cuando éste fracasa. Deben ir acompañados de un protector gástrico en pacientes de riesgo. Pueden alterar las funciones dependientes de la COX-1 como es la gastroprotección, la función renal, la homeostasis vascular y la función plaquetaria. Su uso es en dolor moderado.
- Inhibidores selectivos de la COX-2: Unicamente inhiben la COX-2 que es la mediadora de la inflamación, del dolor y de la fiebre, efectos que son los que realmente queremos eliminar cuando tomamos un antiinflamatorio. No interaccionan con la agregación plaquetaria. Beneficios en relación a los AINES tradicionales: Mayor rapidez de acción. Efecto duradero con una sola toma al día lo que facilita el cumplimiento. Efectividad comparada similar a las dosis altas de AINES tradicionales (indometacina, diclofenaco) en cuanto a alivio del dolor y la inflamación.
- Analgésicos opioides: Son los «temidos parches». Su uso se recomienda como tercer escalón terapéutico, cuando el paracetamol y los AINES no son eficaces o son mal tolerados por el paciente.
- Corticoides intrarticulares: Son las llamadas “infiltraciones”. Inhiben la síntesis de IL-1B y el factor de necrosis tumoral en las zonas donde se inyectan. Reducen la inflamación limitando la liberación de citokinas, y facilitan la remisión de la clínica. La indicación ideal es la afectación de una articulación. Con afectación moderada-severa y cuya sintomatología no cede con el tratamiento habitual. Su eficacia está comprobada. A esta técnica le acompaña una leyenda negra. Su efectividad no tiene discusión, y como cualquier otra medicación requiere no abusar ni en dosis ni en el número. Se pueden poner 3 infiltraciones, separadas cada una por una semana dos veces al año. No está demostrado que necrose el cartílago de las articulaciones ni lo destruya si se siguen las pautas correctas de administración.
[/expand]
[expand title=»6.- ¿Hay fármacos que endentezcan la progresión de la enfermedad?«]
Son los que evalúan a los fármacos que frenan, endentecen o modifican los efectos articulares de la artrosis. También llamados SYSADOA (Symptomatic Slow Action Drugs Osteoarthritis). Son los que modifican la clínica de la enfermedad, mejorando el dolor y la calidad de vida de los pacientes, aunque de acción lenta. No comienzan a hacer efecto analgésico de forma inmediata, por lo que para evitar su abandono por falta de eficacia, es necesario mantener durante las dos o tres semanas iniciales, el tratamiento analgésico correspondiente
Los más importantes son condroitin sulfato, glucosalina, diacereína y el ácido hialurónico intrarticular.
Su efecto analgésico se puede prolongar durante 3 a 6 meses tras suspender el tratamiento. Es lo que se llama efecto carryover.
- Condroitin sulfato: estimula la síntesis de los componentes de la matriz, gracias al aumento de los proteoglicanos y del ácido hialurónico. Además, disminuye la actividad metabólica de los condorcitos, inhibiendo los enzimas que degradan sus proteinas; reduce la síntesis de ácido nítrico, protegiendo la los condrocitos, reduciendo su apoptosis. Se ha demostrado eficaz (nivel de evidencia categoría 1A de eficacia y seguridad según la EULAR) en el tratamiento de la artrosis de una o más articulaciones, mejorando la sintomatología. No se ha reconocido aún la capacidad de modificar el curso de la enfermedad artrósica, por lo que los estudios futuros se encaminan hacia esta posibilidad.
- Glucosamina: estimula a los condrocitos y la síntesis de proteoglicanos, inhibiendo de forma indirecta a las enzimas proteolíticas. Su eficacia es igual o superior en cuanto al alivio del dolor que algunos antiinflamatorios, con una menor incidencia de efectos secundarios y el mantenimiento de su eficacia durante al menos dos meses tras la suspensión del fármaco. Su nivel de evidencia respecto a la mejoría de la sintomatología es 1 A según la EULAR, recomendando ampliamente su uso.
- Diacereína: inhibe la interleukina 1, en TNF alfa y del nisotriol. También es eficaz a la hora de aliviar la sintomatología en la artrosis; hay otros estudios que han evidenciado un enlentecimiento en la progresión del estrechamiento del espacio articular en pacientes con coxartrosis.
- Acido hialurónico intrarticular: se sabe que en la artrosis, hay un descenso del ácido hialurónico, por lo que su reemplazo puede asociarse a una mejoría de la sintomatología. Su vida media dentro de la articulación varía entre 24 horas y 2 semanas. Entre sus potenciales ventajas: Disminuye la fricción de la articulación, estabilizandola. Barrera biomecánica por su viscoelasticidad. Efecto antiinflamatorio. Efecto analgésico. Modula el comportamiento celular intraarticular.
[/expand]
[expand title=»7.- ¿Cuál es el tratamiento más NOVEDOSO?«]
Factores de crecimiento.
La técnica ideal para reparar las lesiones del cartílago que predisponen a la aparición de artrosis, debe llevarse a cabo con un solo procedimiento quirúrgico, obteniendo células mesenquimales pluripotenciales ya sean extraídas de la sangre del propio paciente o a través de técnicas que estimulen la celularidad del hueso subcondral. Evitan la rotura del tejido y la apoptosis o muerte celular. Estas proteínas pueden ser factores anabólicos o morfógenos y factores de crecimiento que amplíen el fenotipo de los condrocitos y los diferencien, mejorando la calidad de la expresión de la matriz que es capaz de producir un tejido hialino óptimo.
Los factores de crecimiento pueden producir un estímulo para la producción de condrocitos o la estimulación de los proteoglicanos articulares que al saturarse de agua, confieren al cartílago la capacidad de resistir la compresión y distribuir homogéneamente las cargas dentro de la articulación. Dentro del gran número del factores de crecimiento, los más importantes son: TGF beta, el factor de crecimiento de fibroblastos (FGF), proteínas morfogenéticas (BMP), pudiendo todos ellos influir en la diferenciación celular (TGF beta 1 y 2), en la proliferación (FGF-2) y en la producción de matriz (IGF 1, BMP-2 a 7). Sin embargo, la vida media de estos factores de crecimiento es corta, limitando su uso a la inyección intraarticular.
La función de los factores de crecimiento no sólo es la de estimular la proliferación celular mediante la regulación del ciclo celular iniciando la mitosis, sino también el mantener la supervivencia celular, estimular la migración celular y la diferenciación celular. Hay estudios en los que se aprecia una mejoría de la sintomatología de los pacientes artrósicos de rodilla de alrededor del 65% sólo en los dos primeros meses de tratamiento con un compuesto basado en plasma rico en factores de crecimiento.
Tratamiento con células madre
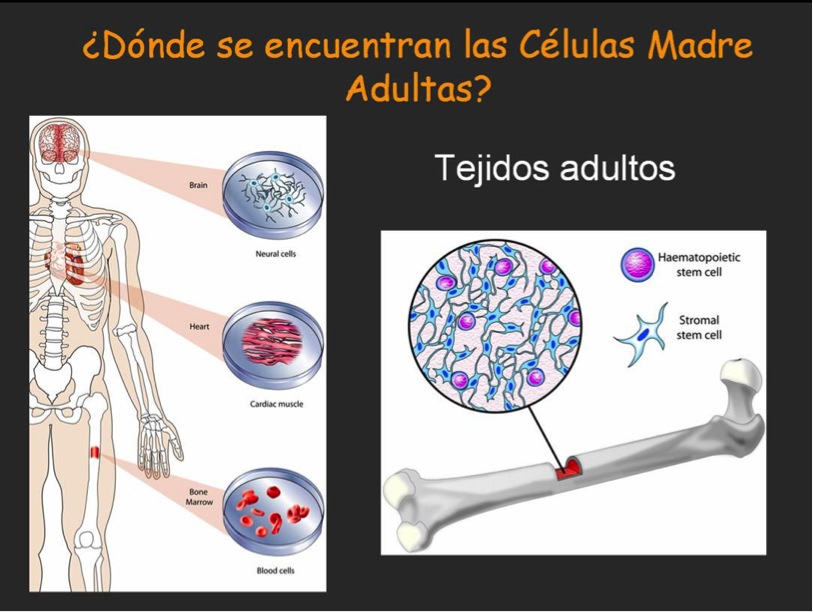
Célula madre o stem cell se define como una célula progenitora, autorenovable, capaz de regenerar uno o más tipos celulares diferenciados.
En los animales superiores, las células madre se han clasificado en dos grupos.
Por un lado, las células madre embrionarias (Embrionic stem o EScells). Estas células derivan de la Masa celular interna del embrión en estadio de blastocisto (7-14 días), y son capaces de generar TODOS los diferentes tipos celulares del cuerpo, por ello se llaman células pluripotenciales. De estas células se derivaran, tras muchas divisiones celulares, el otro tipo de células, la células madre órgano-específicas o células madre del adulto. Estas células son multipotenciales, es decir, son capaces de originar las células de un órgano concreto en el embrión, y también, en el adulto.
El ejemplo más claro de células madre organo-específicas, es el de las células de la médula ósea, que son capaces de generar todos los tipos celulares de la sangre y del sistema inmune. Pero estas células madre existen en muchos más órganos del cuerpo humano, y podemos encontrar en la literatura científica como ya se han aislado células madre de adulto de la piel, grasa subcutánea, músculo cardíaco y esquelético, cerebro, retina, pancreas… A día de hoy, se han conseguido cultivar (multiplicar) estas células tanto en in-vitro (en el laboratorio), como in-vivo (en un modelo animal) utilizándolas para la reparación de tejidos dañados. A pesar de todo, la aplicación de estas técnicas de trasferencia de células madre de adulto para el recambio y reparación de tejidos enfermos está todavía en sus comienzos.
Hasta ahora ha existido la creencia generalizada de que estas células madre órgano específicas, están limitadas a generar sólo células especializadas y diferenciadas del tejido donde residen, es decir, han perdido la capacidad de dar lugar a otras estirpes celulares de cuerpo: son células multipotenciales. Sin embargo la reciente publicación de múltiples estudios ha hecho cambiar esta visión de las células madre órgano-específicas, haciendo evidente que células madre de adulto procedentes de cualquier tejido pueden diferenciarse a células y tejidos de otras localizaciones y estirpes distintas. Estos experimentos han comprobado que células madre de adulto, cultivadas y sometidas a ambientes humorales distintos a los habituales, pueden reprogramarse (TRANSDIFERENCIARSE), y dar lugar a otros tipos celulares que hasta ahora se pensaba que eran incapaces de generar. Es decir, ya no serían multipotenciales, si no pluripotenciales. Si esto es así, se podría decir que no existe una diferencia esencial entre la célula madre embrionarias y las de adulto.
Las células mesenquimales o células madre adultas, las provenientes del propio donante mediante la punción aspiración de médula ósea, se ha postulado como la solución a los problemas que se plantean debido al lento crecimiento de los condrocitos injertados debido a la capacidad de diferenciarse en muchas y diferentes líneas celulares como en mioblastos, osteblastos y condrocitos. Inicialmente se postuló que dichas células se encontraban únicamente en el hueso esponjoso, pero se ha visto que también se pueden obtener de la grasa, del cordón umbilical, de la piel y de la propia sangre. La ventaja principal es que el procedimiento se realiza con células antólogas sin posibilidad de rechazo; otra ventaja es el la producción celular que puede llegar a billones de ellas. Lo ideal es extraerlas, cultivarlas y sembrarlas en una matriz transportadora ideal bajo condiciones de hipoxia y presiones hidrostáticas, junto a agentes que enriquezcan dichos cultivos como factores de crecimiento para que diferencien dichas células hacia condrocitos.
[/expand]
[/toggle]
[/togglegroup]